LLNL研究人员对活体动脉瘤进行生物3D打印并观察其在术后的愈合情况
在美国,大约每50人中就有人因大脑动脉壁弱化而导致的脑动脉瘤,并且以血管膨大为特征,血管破裂会导致脑损伤,中风甚至死亡。来自劳伦斯·利弗莫尔国家实验室(LLNL),杜克大学和得克萨斯州A&M的一组研究人员一直在努力改善当前的外科手术程序,并使它们更具患者特异性。这些科学家使用生物3D打印技术在人体外创建了第一个活体动脉瘤,然后执行了医疗程序,观察它对治疗的反应并像真正的大脑一样愈合。
该团队在《生物制造》杂志上发表了一篇关于他们工作的论文。“在这里,我们使用明胶-纤维蛋白水凝胶开发了三维(3D)打印的带有动脉瘤的血管化组织结构,其内血管壁播有人脑微血管内皮细胞(hCMEC)。 hCMECs容易在整个血管壁(包括动脉瘤壁)周围表现出细胞附着,扩散和融合。此外,该体外平台可直接通过粒子图像测速仪进行流量测量,从而能够直接评估血管流动动力学,以与3D计算流体动力学模型进行比较。”

体外活体脑动脉瘤。 (a)3D打印的动脉瘤生物反应器的图示。 (b)灌注红色荧光珠的体外动脉瘤血管结构,表明在牺牲墨水撤离后形成了专利血管。
显然,脑动脉瘤不容易修复。一种非常有创性的治疗方法是将金属夹固定在底座上,以重新引导血液流离底座,并且需要外科医生打开颅骨并暴露大脑。另一种常见的但侵入性较小的治疗方法称为血管内金属盘绕术,该方法涉及外科医生将细金属导管插入患者腹股沟的动脉中,并将其一直馈入整个身体并进入动脉瘤。然后,他们将其与支架或线圈包装在一起,这会导致血栓,而在该血栓塞上生长的血管会在凝结的栓塞上方生长,基本上在动脉瘤周围形成一堵壁,从而使其与其余脉管系统分开。不幸的是,这两种治疗方法的结果通常因患者而异。
“尽管有很多有前途的治疗选择,但有些还有很长的路要走。 LLNL工程师兼首席研究员莫妮卡·莫亚(Monica Moya)表示,动物模型不一定是尝试这些选择的最佳方法,因为它们无法直接观察到治疗效果,并且动脉瘤的几何形状无法控制。 “拥有这个强大的人体体外测试平台可以帮助促进新的治疗方法。如果我们能够使用这些设备尽可能多地复制动脉瘤,我们可能会帮助将其中一些产品加速进入临床,并从根本上为患者提供更好的治疗选择。”
之前曾使用3D打印来帮助外科医生使用模型来训练这些复杂的程序,甚至实时监控脑动脉瘤。但是由LLNL领导的研究小组能够通过使用人脑细胞创建生物打印的血管来在体外复制脑动脉瘤。另一位LLNL工程师最初的首席研究员William“ Rick” Hynes认为,用人体细胞进行生物打印可以帮助医学研究人员创建和验证更具预测性,针对患者的生物学相关3D模型。
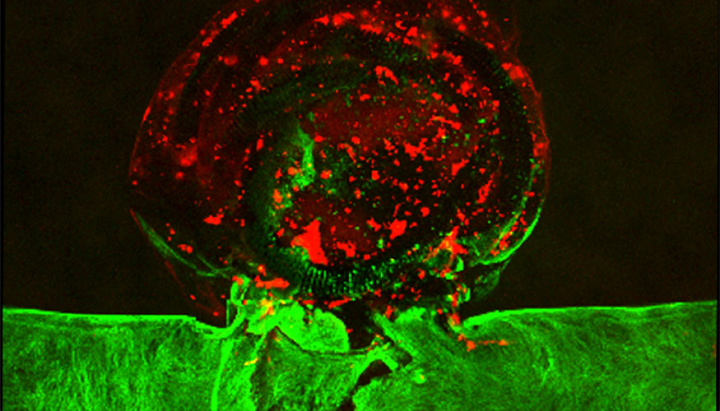
LLNL团队使用3D打印在体外复制动脉瘤并对其进行了血管内修复程序,将导管插入血管中,并将铂金线圈紧密地包装在动脉瘤囊内。他们将血浆引入动脉瘤,并观察到线圈所在的地方有血块形成。绿色区域表示内皮细胞,红色区域表示形成的血块。 LLNL Elisa Wasson摄
Hynes说:“我们研究了这个问题,并认为,如果我们可以将计算模型和实验方法结合起来,也许我们可以提出一种更具确定性的方法来治疗动脉瘤或选择最适合患者的治疗方法。现在,我们可以开始建立个性化模型的框架,外科医师可以使用该模型来确定治疗动脉瘤的最佳方法。”Hynes和Moya与前LLNL科学家Duncan Maitland合作,后者是德克萨斯A&M生物医学工程团队的负责人,同时也是Shape Memory Medical的负责人,该公司正在开发用于动脉瘤治疗的实验性形状记忆线圈;另一位前LLNL科学家,现任杜克大学助理教授阿曼达·兰德斯(Amanda Randles)为这项工作开发了用于模拟血流的代码。该论文的其他作者是Lindy K. Jang(得克萨斯A&M),Javier A. Alvarado(LLNL),Marianna Pepona(杜克),Elisa M. Wasson(LLNL),Landon D. Nash(Shape Memory Medical)和Jason M奥尔特加(LLNL)
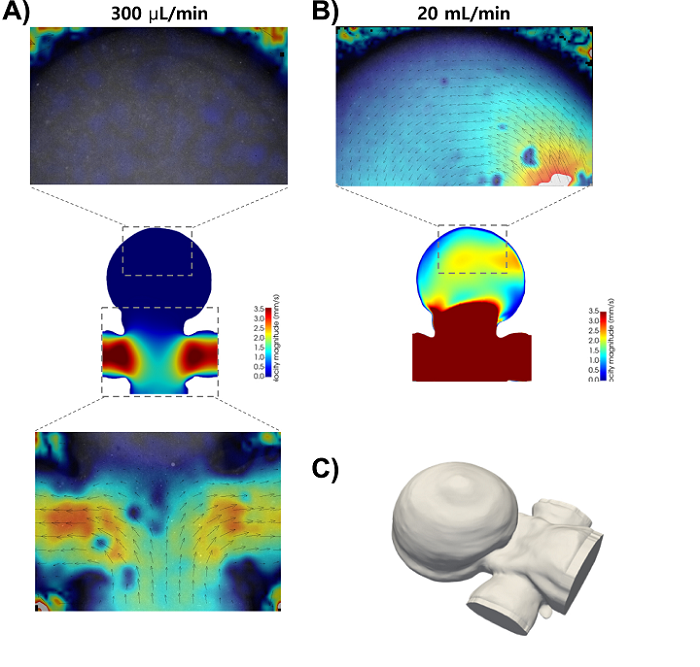
粒子图像测速(PIV)分析和3D计算流动模型仿真。 (a)(上)动脉瘤圆顶后部的PIV测量显示,在300 µl min-1的流速下没有可检测到的流量。 (中)在z = -0.66 mm时,具有相同几何形状和流速的3D流动模拟。 (下图)以相同的流速用2x物镜捕获的母子血管内的PIV测量值。 (b)(上图)PIV测量值聚集在动脉瘤穹顶的背面,显示出圆形的流动模式,并以4倍物镜以20 ml min-1的流速捕获。 (下图)对相同几何形状和流速的模拟,表明流体运动仅在高流速下在圆顶内发生。 (c)从通过共聚焦显微镜收集的图像堆栈构建的印刷活体动脉瘤的高保真几何重建。
该团队为SOLIDWORKS中的动脉瘤平台设计了生物反应器侧壁,并使用开源Slic3r软件将设计转换为G代码。然后使用定制的挤压式生物打印机,将壁从SE-1700硅酮上打印到载玻片上,然后将其固化并在高压釜中灭菌。使用牺牲性墨水打印血管的几何形状,并用基于蛋白质的水凝胶包围;将其冷却以溶解墨水,从而留下脉管形状。人脑内皮细胞覆盖通道,形成动脉瘤和血管。Hynes通过在囊内插入微导管和紧密包装的铂金线圈对生物打印的动脉瘤进行了修复。然后,研究人员引入血浆,并观察在动脉瘤上线圈处的血凝块形成形式,将其从液流中切断。 LLNL认为这是“有史以来首次对人造活体组织进行的外科手术”八天后,研究团队亲眼看到了血管内内皮的术后愈合过程。
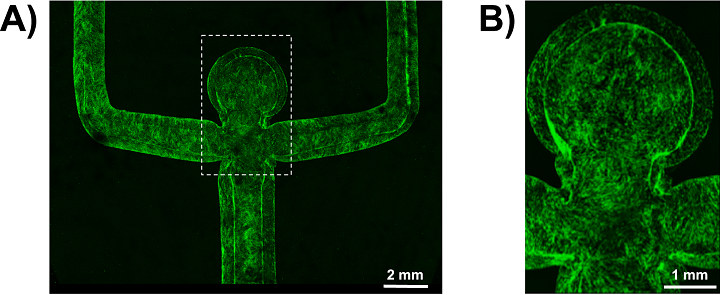
动脉瘤印刷血管的内皮化。 (a)灌注培养7天后肌动蛋白染色的内皮细胞的共聚焦图像。 (b)在动脉瘤圆顶内肌动蛋白染色的内皮(绿色)的特写照片,表明完全融合的单层生长。
研究人员还使用该设备展示了Randles流动动力学模型的有效性,注意到在低流速下血液很少进入动脉瘤,而在流速增加时循环血流更快,就像人类病人激动时会发生什么一样。 。LLNL表示,与计算机建模结合使用时,该平台是在基于血压和血管几何形状等因素创建针对患者的脑动脉瘤护理方面迈出的重要一步,这可以帮助加快复杂手术技术的处理时间。前往培训诊所。外科医生可以将其用作在手术前选择最佳动脉瘤填充线圈的工具。
“基本上,临床医生可以从字面上看某人的脑部扫描,并通过建模软件运行它,该软件可以在治疗之前显示流体动力学。 Hynes解释说,它也应该能够模拟该处理方法,并允许从业者缩小到某种类型的线圈或包装体积,以确保获得最佳结果。

在体外动脉瘤内部署血管内裸铂线圈(BPC)介入治疗。 (一)与动脉瘤圆顶双线圈部署的图像。 (b)在从血管内微导管插入BPC期间进行明场监视的显微照片(第一BPC:3 mm×6 cm,第二BPC:2 mm×3 cm)。 (c)在BPC展开和缩回(2 mm×3 cm)之前和之后(d)的人造动脉瘤的最大投影共聚焦图像叠层,其中充满了1 µm红色荧光珠,表明在插入过程中对囊的破坏没有。
该平台还可以用于更好地了解基础生物学和术后康复,以及提前进行测试运行,而无需诱使动物患有动脉瘤然后进行手术。它可以直接测量动脉瘤和血管内部的流体动力学,而动物无法做到这一点。“这是计算机模拟模型的理想平台,因为我们可以进行这些流量测量,而如果在动物体内进行这些测量将非常困难。令人兴奋的是,该平台模仿了血管顺应性和脑组织的机械刚度。它也足够坚固,可以处理卷取程序。莫亚说:“您看到血管在扩张并移动,但它能够经受住手术,就像您在体内一样。这使其非常适合用作外科医生的培训平台或栓塞设备的体外测试系统。”
血浆凝块形成对BPC在体外活体动脉瘤穹顶内展开的反应。 BPC部署并注入牛血浆后,完整体外动脉瘤的最大投影共聚焦图像堆栈。通过血浆混合物中所含痕量荧光标记的红色人血纤蛋白原的积累,可以看到血块的形成。内皮细胞被肌动蛋白荧光染色为绿色。成像显示动脉瘤囊的血块形成和闭塞,在血管结构的其他部位没有大的血块形成。
LLNL团队表示,这个平台在早期阶段就显示出了希望。他们的下一步是将LLNL计算工程师Ortega创建的2D血液凝结模型与Randles的3D流体动力学模型相结合,以模拟引起动脉瘤的血凝块如何响应3D线圈而形成。














评论交流